INTRODUCCIÓN
En el presente trabajo enseñaremos que a nuestro alrededor continuamente están sucediendo cambios en la materia, que implican la transformación de unas sustancias en otras de naturaleza diferente. el proceso mediante el cual se producen estos cambios químicos se conoce como reacción química los cuales van de la mano con las ecuaciones químicas.
REACCIONES QUÍMICAS
A finales del siglo xvlll, un noble francés, llamado Antonie lavoisier, observo que la masa total de todas las sustancias presentes al final de una reacción química era la misma que antes de que tuviera lugar. Dicha observación, conocida como ley de conservación de la masa, es una de las leyes fundamentales de los cambios químicos.
Con la llegada de la teoría atómica, los químicos comprendieron la base de esta ley: los átomos ni se crean ni se destruyen durante una reacción química. Así pues, la misma colección de átomos está presente antes y después de que la reacción tenga lugar. Los cambios ocurridos durante un proceso químico suponen, "sencillamente", un reordenamiento de átomos.
Del estudio de estos cambios se hace cargo la estequiometría. la estequiometría es una herramienta esencial en química que se usa para estudiar problemas tan diversos, como medir la concentración de ozono en la atmósfera o determinar el rendimiento potencial de una mina de oro. Todos ellos, implican aspectos de estequiometría.
Una reacción química es un proceso mediante el cual una o mas sustancias iniciales, denominadas reactivos, se combinan entre si para transformarse en otra u otras, de distinta naturaleza denominadas productos.
las nuevas sustancias originadas tienen composiciones y propiedades físicas diferentes a las de las sustancias iniciales. Esas propiedades diferentes pueden implicar un cambio en el color, en la temperatura o en el estado de agregación. Las reacciones químicas son, por tanto, cambios químicos. Por el contrario, en un cambio físico se altera la apariencia de una sustancia, pero no su composición.
Por ejemplo, cundo la plata, Ag, reacciona con azufre, S, que puede estar en el aire, pierde su lustre porque se recubre de una sustancia oscura opaca que llamamos sulfuro de plata, Ag2s
Con la llegada de la teoría atómica, los químicos comprendieron la base de esta ley: los átomos ni se crean ni se destruyen durante una reacción química. Así pues, la misma colección de átomos está presente antes y después de que la reacción tenga lugar. Los cambios ocurridos durante un proceso químico suponen, "sencillamente", un reordenamiento de átomos.
Del estudio de estos cambios se hace cargo la estequiometría. la estequiometría es una herramienta esencial en química que se usa para estudiar problemas tan diversos, como medir la concentración de ozono en la atmósfera o determinar el rendimiento potencial de una mina de oro. Todos ellos, implican aspectos de estequiometría.
Una reacción química es un proceso mediante el cual una o mas sustancias iniciales, denominadas reactivos, se combinan entre si para transformarse en otra u otras, de distinta naturaleza denominadas productos.
las nuevas sustancias originadas tienen composiciones y propiedades físicas diferentes a las de las sustancias iniciales. Esas propiedades diferentes pueden implicar un cambio en el color, en la temperatura o en el estado de agregación. Las reacciones químicas son, por tanto, cambios químicos. Por el contrario, en un cambio físico se altera la apariencia de una sustancia, pero no su composición.
Por ejemplo, cundo la plata, Ag, reacciona con azufre, S, que puede estar en el aire, pierde su lustre porque se recubre de una sustancia oscura opaca que llamamos sulfuro de plata, Ag2s
Para comprender de manera exitosa este tema, primero debemos saber identificar, reconocer y trabajar los siguientes términos los cuales van de la mano con las reacciones quimicas.
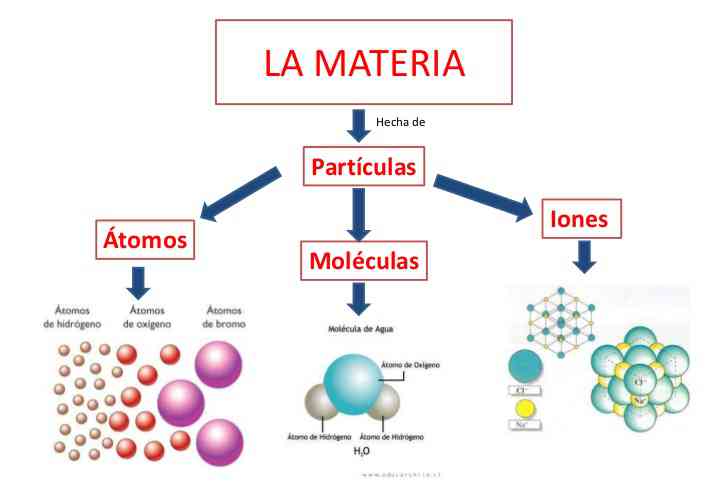
La materia: en forma sencilla se puede afirmar que todo aquello que existe en el universo, capaz de impresionar nuestros sentidos y que posee masa, es materia. la masa, es pues, la expresión de la cantidad de materia, pero teniendo en cuenta, al efectuar la medición, la fuerza de atracción que ejerce la tierra, es decir, la gravedad. ahora bien, como la fuerza de gravedad varia en los distintos puntos de la tierra, el peso también será variable en tanto que varia su localización sobre la superficie terrestre. De allí que sea mas exacto hablar de la masa de un cuerpo que de su peso.
la materia, ademas de la característica fundamental mencionada, posee características que estudia y aprovecha diariamente el hombre para su beneficio. Estas características se agrupan en físicas y químicas.
Entre las características físicas hay que destacar el volumen y la densidad.
el volumen se considera como el espacio ocupado por un cuerpo. todos los cuerpos ocupan un espacio. la densidad es la resultante de relacionar la masa con el volumen de un cuerpo. En otras palabras la densidad es la masa o cantidad de materia que existe en la unidad de volumen.
En general, son características físicas de la materia todas aquellas que no cambien la naturaleza del material que constituye el cuerpo en estudio.
Existen otras características que originan la transformación de unas sustancias en otras, cambiándose por consiguiente la naturaleza de los diferentes materiales, denominadas químicas y que son precisamente las que estudia la química.
cabe pues distinguir dos tipos de cambios en la materia:
clasificación de la materia: la materia se puede presentar en forma homogénea y se tienen entonces sustancias puras, compuestas o simples: compuestos o elementos; ejemplo: agua, plata, alcohol, hierro; o en forma heterogénea y se tienen las mezclas de sustancias; ejemplo: las disoluciones.
Energía: la mayoría de cambios que ocurren en la naturaleza llevan implícitas una cualidad o "espíritu" que anima dicho cambio. Esta cualidad es la energía. La energía es la capacidad de efectuar trabajo y matemáticamente es idéntica al trabajo, En la naturaleza, la energía se manifiesta de diferentes maneras: caloría, radiante, mecánica, química y eléctrica. En términos muy generales todo cuerpo tiene una energía total "ET" que es igual a la suma de todos los tipos de energía que puede manifestar. así por ejemplo un cuerpo en reposo posee una energía ET, si este cuerpo se mueve cuesta abajo, parte de esa energía se convierte en movimiento, parte se emplea para producir calor o ruido.
En el estudio de la química, la energía calorica desarrolla un papel importante para iniciar, detener o continuar procesos de transformación de materiales.
las transformaciones de energía mas significativas en la naturaleza son las que tienen relación con la conservación de la vida. Según esto la energía radiante que proviene del sol es la mas importante, ya que es la que emplean los vegetales para elaborar alimentos; La energía almacenada en estos alimentos se utiliza luego en los organismos animales para originar movimientos de todo tipo.
Los físicos miden la energía empleando algunas unidades definidas a su vez por las de fuerza y distancia. estas unidades se estudian en el curso de física.


REACCIONES DE SUSTITUCIÓN:
Una Reacción de sustitución es aquella donde un átomo o grupo en un compuesto químico es sustituido por otro átomo o grupo. Son procesos químicos donde las sustancias intervinientes, sufren cambios en su estructura, para dar origen a otras sustancias. El cambio es más fácil entre sustancias líquidas o gaseosas, o en disolución, debido a que se hallan más separadas y permiten un contacto más íntimo entre los cuerpos reaccionantes.
En pocas palabras, en una reacción de sustitución, un átomo o ion, desplaza a otro átomo o ion en un compuesto. Pueden ser de sustitución simple o de sustitución doble.
Por ejemplo, el metano (o gas natural), CH4, reacciona con oxigeno, O2, para producir dioxido de carbono (CO2), agua (H2O), y calor.

Este tipo de reacciones se denominan de combustión completa, ya que el combustible, en este caso el matano, se oxida completamente generando dióxido de carbono, agua y demás productos de combustión (como óxidos de nitrógeno).
hasta ahora, hemos balanceado las ecuaciones químicas teniendo en cuenta el numero de átomos de cada especie en los reactivos y productos. sin embargo, en la practica, cuando se realizan experimentos en el laboratorio las muestras contienen tantos átomos y moléculas, que resulta imposible contarlos individualmente.
las ecuaciones químicas se pueden interpretar teniendo en cuenta lo que sucede a escala atómica (interpretación microscópica) y lo que sucede con cantidades medibles de reactivos y productos (interpretación macroscopica).




Una ecuación química es un enunciado que utiliza fórmulas químicas para describir las identidades y cantidades relativas de los reactivos y productos involucrados en una reacción química.
Para poder representar lo que ocurre en una reacción química mediante una ecuación, ésta debe cumplir con la Ley de la conservación de la materia y con la Ley de conservación de la energía. Es decir, la ecuación debe indicar que el número de átomos de los reactivos y productos es igual en ambos lados de la flecha y que las cargas también lo son. Dicho en otras palabras, se debe contar con una ecuación balanceada.
Las expresiones abreviadas que dan informaciones acerca de las reacciones químicas se llaman ecuaciones químicas y, de la misma forma que las ecuaciones matemáticas aceptan un tratamiento como tales, es decir, se pueden sumar, restar, multiplicar o dividir sus dos lados por un mismo numero y la ecuación permanece.
las ecuaciones quimicas son formas de describir las reacciones abreviadamente. Nos informan acerca de los siguientes aspectos:

2- Escribe el símbolo químico para el primer elemento. Después de escribir el nombre de un compuesto, debes identificar los elementos que lo componen y saber sus símbolos químicos. El primer elemento que se escribe en la fórmula es el "segundo nombre" del compuesto. Usa la tabla periódica para encontrar el símbolo químico del elemento.
Por ejemplo: hexafluoruro de dinitrógeno. El primer elemento es el nitrógeno y el símbolo químico del nitrógeno es N.

3- Añade el número de átomos como un subíndice. Para identificar la cantidad de átomos presentes en cada elemento, simplemente debes observar el prefijo del elemento. Memorizar los prefijos griegos te ayudará a escribir fórmulas químicas rápidamente sin tener que buscar nada.
Por ejemplo: dinitrógeno tiene el prefijo "di", que quiere decir 2. Por lo tanto, hay dos átomos de nitrógeno presentes.
Escribe "dinitrógeno" como N2.

4- Escribe el símbolo químico del segundo elemento. El segundo elemento es el "primer nombre" del compuesto y seguirá al primer elemento. Para los compuestos covalentes, el nombre del elemento tendrá el sufijo "uro" (o "ido" en caso de que el elemento sea oxígeno) en lugar de la terminación habitual del elemento.[4]
Por ejemplo: hexafluoruro de dinitrógeno. El segundo elemento es el fluoruro. Dado que "fluoruro" ya termina en "uro", simplemente déjalo como está. El símbolo químico del fluoruro es F.

5- Añade la cantidad de átomos presentes como un subíndice. Como lo hiciste con el primer elemento, identifica la cantidad de átomos presentes en el segundo elemento leyendo el prefijo. Usando este prefijo, escribe la cantidad de átomos como un subíndice a la derecha del símbolo químico.
Por ejemplo: hexafluoruro tiene el prefijo "hexa", que quiere decir 6. Por lo tanto, hay 6 átomos de fluoruro presentes.
Escribe "hexafluoruro" como F6.
La fórmula química final para el hexafluoruro de dinitrógeno es N2F6.

6- Practica con algunos ejemplos. Cuando apenas empiezas a aprender química, hay mucha memorización involucrada. Es un poco como aprender un nuevo idioma. Mientras más ejemplos utilices para practicar, te será más fácil descifrar las fórmulas químicas en el futuro y aprender el idioma de la química.
Dióxido de azufre: SO2
Tetrabromuro de carbono: CBr4
Pentóxido de difósforo: P2O5

Escribir formulas químicas de compuestos iónicos:
1- Identifica los símbolos químicos de los cationes y aniones. Todos los químicos tienen lo que puede llamarse un nombre y apellido. El nombre es el anión (ion negativo) mientras que el apellido es el catión (ion positivo). Los cationes se escriben como el nombre del elemento mientras que los aniones son el nombre del elemento con el sufijo "uro" (o "ido" en el caso de iones que contengan oxígeno).
Puedes encontrar el símbolo químico para cada elemento en la tabla periódica.
A diferencia de los compuestos covalentes, los prefijos griegos no se usan para indicar el número de átomos en cada elemento. Tienes que balancear las cargas de los elementos para determinar los átomos.
Por ejemplo, el óxido de litio es Li2O.

2- Reconoce los iones poliatómicos. A veces, el catión o anión es un ion poliatómico. Estos son moléculas que tienen dos o más átomos con grupos iónicos. No hay un buen truco para recordarlos, solo tienes que memorizarlos.
Solo existen 3 cationes poliatómicos y son el amonio (NH4+), el hidronio (H3+) y el mercurio (I) (Hg22+). Todos tienen una carga de +1.
El resto de los iones poliatómicos tiene cargas negativas que van desde el -1 hasta el -4. Algunos iones comunes son el carbonato (CO32-), el sulfato (SO42-), el nitrato (NO3-) y el cromato (CrO42-).

3- Determina la carga de valencia de cada elemento. La carga de valencia puede determinarse observando la posición del elemento en la tabla periódica. Hay unas cuantas reglas que debes tener en mente para ayudarte a identificar las cargas:[8]
Todos los elementos del grupo 1 tienen una carga de +1.
Todos los elementos del grupo 2 tienen una carga de +2.
Los elementos de transición tendrán números romanos para indicar la carga.
La carga de la plata es +1, la del zinc es +2 y la del aluminio es +3.
Los elementos del grupo 17 tienen una carga de -1.
Los elementos del grupo 16 tienen una carga de -2.
Los elementos del grupo 15 tienen una carga de -3.
Recuerda: al trabajar con iones poliatómicos, solo usa la carga del ion.

4- Balancea las cargas positivas y negativas de los iones. Una vez que hayas identificado la carga de cada elemento (o ion poliatómico), usarás estas cargas para determinar la cantidad de átomos presentes en cada elemento. La carga del compuesto debe ser igual a cero, así que añadirás átomos para balancear las cargas.[9]
Por ejemplo: el óxido de litio. El litio es un elemento del grupo 1 y tiene una carga de +1. El oxígeno es un elemento del grupo 16 y tiene una carga de -2. A fin de balancear la carga de -2 del oxígeno, necesitas dos átomos de litio. Por lo tanto, la fórmula química del óxido de litio es Li2O.

5- Practica con algunos ejemplos. La mejor forma de aprender a escribir las fórmulas es practicando con muchos ejemplos. Usa ejemplos de tu libro de química o busca ejercicios de práctica en línea. Haz tantos como puedas hasta que te sientas cómodo escribiendo fórmulas químicas.
Nitruro de calcio: el símbolo del calcio es Ca y el símbolo del nitrógeno es N. El calcio es un elemento del grupo 2 y tiene una carga de +2. El nitrógeno es un elemento del grupo 15 y tiene una carga de -3. Para balancearlo, necesitas 3 átomos de calcio (+6) y 2 átomos de nitrógeno (-6): Ca3N2.
Fosfato de mercurio (II): el símbolo del mercurio es Hg y el fosfato es el ion poliatómico PO4. El mercurio tiene una carga de +2 como lo indica el número romano II junto a él. El fosfato tiene una carga de -3. A fin de balancearlos, necesitarás 3 átomos de mercurio (+6) y 2 moléculas de fosfato (-6): Hg3(PO4)2.

ejemplo: cuando el gas metano CH4 arde en el aire, se produce gas carbónico y agua; la reacción química es:
Esta reacción no se puede considerar como una ecuación debido a que en el primer miembro o (antes de la flecha) existen solamente dos átomos. igualmente, existen dos átomos de oxigeno en el primer miembro y tres átomos en el segundo miembro. El tanteo indica que para igualar los átomos de hidrógeno, se requiere anteponer el coeficiente 2 a la formula del agua en el segundo miembro (multiplique el coeficiente por el subíndice). Quedan ahora cuatro átomos de oxigeno en el segundo miembro y dos átomos en el primer miembro. Para igualarlos basta anteponer el coeficiente dos a la formula de la molécula de oxigeno. la ecuación está ajustada.
El metodo anterior se emplea en aquellas reacciones en que solo se producen desplazamientos o sustituciones, o cuando los procesos de oxidacion o reduccion son simples.
Método de números de oxidación: Se trata aquí de encontrar cual es el cambio total en el numero de oxidación para el oxidante y para el reductor e igualarlos. para ello se siguen las siguientes reglas:
la materia, ademas de la característica fundamental mencionada, posee características que estudia y aprovecha diariamente el hombre para su beneficio. Estas características se agrupan en físicas y químicas.
Entre las características físicas hay que destacar el volumen y la densidad.
el volumen se considera como el espacio ocupado por un cuerpo. todos los cuerpos ocupan un espacio. la densidad es la resultante de relacionar la masa con el volumen de un cuerpo. En otras palabras la densidad es la masa o cantidad de materia que existe en la unidad de volumen.
En general, son características físicas de la materia todas aquellas que no cambien la naturaleza del material que constituye el cuerpo en estudio.
Existen otras características que originan la transformación de unas sustancias en otras, cambiándose por consiguiente la naturaleza de los diferentes materiales, denominadas químicas y que son precisamente las que estudia la química.
cabe pues distinguir dos tipos de cambios en la materia:
- cambios que no modifican la naturaleza de la materia denominados cambios físicos, tales como los cambios de estado, las mezclas, los cambios de forma y el movimiento.
- cambios que modifican la naturaleza de los materiales, denominados químicos, tales como: cambios de color, olor y sabor, debido a las transformaciones de unas sustancias en otras por efecto de ciertos factores, tales como la luz, el calor la presión, o la presencia de otras sustancias.
clasificación de la materia: la materia se puede presentar en forma homogénea y se tienen entonces sustancias puras, compuestas o simples: compuestos o elementos; ejemplo: agua, plata, alcohol, hierro; o en forma heterogénea y se tienen las mezclas de sustancias; ejemplo: las disoluciones.

Energía: la mayoría de cambios que ocurren en la naturaleza llevan implícitas una cualidad o "espíritu" que anima dicho cambio. Esta cualidad es la energía. La energía es la capacidad de efectuar trabajo y matemáticamente es idéntica al trabajo, En la naturaleza, la energía se manifiesta de diferentes maneras: caloría, radiante, mecánica, química y eléctrica. En términos muy generales todo cuerpo tiene una energía total "ET" que es igual a la suma de todos los tipos de energía que puede manifestar. así por ejemplo un cuerpo en reposo posee una energía ET, si este cuerpo se mueve cuesta abajo, parte de esa energía se convierte en movimiento, parte se emplea para producir calor o ruido.
En el estudio de la química, la energía calorica desarrolla un papel importante para iniciar, detener o continuar procesos de transformación de materiales.
las transformaciones de energía mas significativas en la naturaleza son las que tienen relación con la conservación de la vida. Según esto la energía radiante que proviene del sol es la mas importante, ya que es la que emplean los vegetales para elaborar alimentos; La energía almacenada en estos alimentos se utiliza luego en los organismos animales para originar movimientos de todo tipo.
Los físicos miden la energía empleando algunas unidades definidas a su vez por las de fuerza y distancia. estas unidades se estudian en el curso de física.

CLASES DE REACCIONES QUIMICAS
las reacciones químicas se pueden clasificar atendiendo a diferentes criterios. Por ejemplo, en función de la energía implicada en el proceso, se pueden clasificar como reacciones exotermicas (si desprenden energía) y reacciones endotermicas (si absorben energía). Otra posible clasificación es en función de las partículas transferidas durante el proceso. Así, tendremos reacciones de transferencia de protones (ácido - base) y reacciones de transferencia de electrones (oxidación-reducción). También podrían clasificare, según su cinética, en lentas y rápidas; o según la variación del desorden sufrido entre el sistema y el entorno, en espontaneas y no espontaneas.
sin embargo, para abordar estos tipos de clasificaciones es preciso conocer determinados conceptos que se trataran mas adelante. No obstante, existe una clasificación clásica, que contempla una serie de protones generales a los cuales se ajustan todas las reacciones, aunque algunas pueden encajar en mas de un tipo. Esta clasificación se realiza en función de las transformaciones sufridas por lo reactivos y así la reacciones pueden ser: de síntesis o combinación, de descomposición, de sustitución y de combustión.
Los químicos determinan experimentalmente lo que ocurre cuando reaccionan diferentes compuestos o sustancias. Identifican claramente cuales son los reactivos y que se produce. Así mismo, analizan las condiciones experimentales para producir una reacción.
Generalmente, las reacciones químicas y, por tanto las ecuaciones que las representan se agrupan en:
Reacciones de:
combinación o sintesis
descomposición
doble desplazamiento
desplazamiento
REACCIÓN DE SÍNTESIS:
Las reacciones químicas pueden ser clasificadas en cuanto a la naturaleza de su reacción. Así, estas pueden ser de síntesis o descomposición.
Las reacciones de síntesis son aquellas en que dos sustancias se combinan, dando origen a nuevas sustancias, esto es, que ocurre un fenómeno en el cual existe rompimiento de enlaces químicos en los reactivos y formación de otros enlaces, dando origen a nuevas especies.
A + B = AB
por ejemplo, el oxido de magnesio (Mgo), se forma al hacer arder magnesio, Mg, en presencia de oxigeno, o2.
la producción de amoniaco es un ejemplo muy importante de reacción de sintesis, ya que se emplea para obtener de materia industrial esta sustancia. El amoniaco se usa habitualmente como fertilizante y como producto de limpieza.
N2(g) + 3H2(g) ---- 2NH3(g)
REACCIÓN DE DESCOMPOSICIÓN:

En este tipo de reacción química un determinado compuesto se descompone en sustancias más simples o en los elementos que lo constituyen. Ocurre naturalmente en la degradación de los suelos a través del tiempo, en forma inducida industrialmente y en el laboratorio. Se utiliza muchas veces en los laboratorios para determinar los constituyentes que están presentes en un determinado compuesto o para buscar la estabilidad en los mismos.
Inicialmente en este tipo de reacciones, tenemos un compuesto AB, que se descompone en A y B que pueden ser elementos o compuestos más simples:
AB → A + B
Reactante Productos
Una Reacción de sustitución es aquella donde un átomo o grupo en un compuesto químico es sustituido por otro átomo o grupo. Son procesos químicos donde las sustancias intervinientes, sufren cambios en su estructura, para dar origen a otras sustancias. El cambio es más fácil entre sustancias líquidas o gaseosas, o en disolución, debido a que se hallan más separadas y permiten un contacto más íntimo entre los cuerpos reaccionantes.
En pocas palabras, en una reacción de sustitución, un átomo o ion, desplaza a otro átomo o ion en un compuesto. Pueden ser de sustitución simple o de sustitución doble.
- En una reacción de sustitución simple, un átomo no combinado toma el lugar de otro en un compuesto.
- En una reacción de sustitución doble, dos tipos de átomos se desplazan mutuamente de sendos compuestos. en ellas, los iones positivos de los compuestos que reaccionan, cambian de lugar en los productos.
REACCIONES DE COMBUSTIÓN: las reacciones de combustión forman un grupo de procesos químicos en los que el oxigeno reacciona con otra sustancia, denominada combustible, y que se desprende gran cantidad de calor y emisión de luz. Los combustibles mas usados son sustancias que contienen carbono e hidrógeno y pueden ser sólidos (carbón o madera), líquidos (gasóleo) o gases (propano o gas natural).
En una reacción de combustión se requiere oxigeno y se produce un oxido y, con frecuencia, agua y energía
Por ejemplo, el metano (o gas natural), CH4, reacciona con oxigeno, O2, para producir dioxido de carbono (CO2), agua (H2O), y calor.
CH4(g) + 2O2(g) ----- CO2(g) + 2H2O(g) + calor
Este tipo de reacciones se denominan de combustión completa, ya que el combustible, en este caso el matano, se oxida completamente generando dióxido de carbono, agua y demás productos de combustión (como óxidos de nitrógeno).
CÁLCULOS CON REACCIONES QUÍMICAS. ESTEQUIOMETRIA
hasta ahora, hemos balanceado las ecuaciones químicas teniendo en cuenta el numero de átomos de cada especie en los reactivos y productos. sin embargo, en la practica, cuando se realizan experimentos en el laboratorio las muestras contienen tantos átomos y moléculas, que resulta imposible contarlos individualmente.
las ecuaciones químicas se pueden interpretar teniendo en cuenta lo que sucede a escala atómica (interpretación microscópica) y lo que sucede con cantidades medibles de reactivos y productos (interpretación macroscopica).
- interpretación microscópica de las reacciones químicas. supongamos la siguiente ecuación química balanceada:
2NO(g) + O2(g) ----- 2NO2(g)
a escala molecular, esta ecuación indica que dos moléculas de monoxido de nitrógeno, NO, reaccionan con una molécula de oxigeno, O2; para producir dos moléculas de dióxido de nitrógeno NO2.

- Los coeficientes de una ecuación química balanceada, a nivel microscópico, indican el numero relativo de moléculas de reactivos y productos que participan en la reacción química correspondiente.
Interpretación macroscopica de las reacciones químicas: La misma reacción anterior no se puede interpretar suponiendo que en el matraz de reacción solo hay dos moléculas de NO y una de O2. Los coeficientes de la ecuación en este caso muestran la proporción de moléculas que reaccionan, y esta proporción se cumple para cualquier cantidad de reactivos:

cualquier numero de moléculas que mantenga la misma proporción, es valido para interpretar la reacción. Para ello, resulta muy practico usar la constante de avogadro.

puesto que la constante de avogadro indica el numero de moléculas que hay en un mol, la reacción se puede interpretar también así:

Los coeficientes de una ecuación química balanceada, a nivel microscopio, indican el numero relativo de moles de reactivos y productos en la reacción química correspondiente.
La interpretación macroscopica de las reacciones no solo se hace en términos de moles, sino que también se puede hacer en términos de masa y volúmenes, en el caso de que las sustancias se encuentren en estado solido y gaseoso, respectivamente.
ECUACIONES QUÍMICAS
Una ecuación química es un enunciado que utiliza fórmulas químicas para describir las identidades y cantidades relativas de los reactivos y productos involucrados en una reacción química.
Para poder representar lo que ocurre en una reacción química mediante una ecuación, ésta debe cumplir con la Ley de la conservación de la materia y con la Ley de conservación de la energía. Es decir, la ecuación debe indicar que el número de átomos de los reactivos y productos es igual en ambos lados de la flecha y que las cargas también lo son. Dicho en otras palabras, se debe contar con una ecuación balanceada.
Las expresiones abreviadas que dan informaciones acerca de las reacciones químicas se llaman ecuaciones químicas y, de la misma forma que las ecuaciones matemáticas aceptan un tratamiento como tales, es decir, se pueden sumar, restar, multiplicar o dividir sus dos lados por un mismo numero y la ecuación permanece.
las ecuaciones quimicas son formas de describir las reacciones abreviadamente. Nos informan acerca de los siguientes aspectos:
- reactivos y productos separados por una flecha.
- cantidad de cada uno
Se llama ecuación porque la cantidad de átomos en los reactivos es igual a la cantidad de átomos en los productos en una ecuación balanceada.
COMO ESCRIBIR UNA ECUACIÓN QUÍMICA
escribir formulas químicas de compuestos covalentes:
1- Memoriza los prefijos para la cantidad de átomos. Al nombrar compuestos, se usan los prefijos griegos para indicar la cantidad de átomos presentes en cada elemento. En los compuestos covalentes, el primer elemento se escribe completamente mientras que al segundo elemento se le añade el sufijo "uro" (o "ido" cuando el elemento es oxígeno). Sin embargo, al escribir el nombre del compuesto, este orden se invierte y el segundo elemento se escribe primero. Por ejemplo, el trisulfuro de difósforo tiene una fórmula química de P2S3.[1] A continuación encontrarás los prefijos para los números de átomos del 1 al 10:
mono-; di-; tri-; tetra-; penta-; hexa-; hepta-; octa-; nona-; deca-
Por ejemplo: hexafluoruro de dinitrógeno. El primer elemento es el nitrógeno y el símbolo químico del nitrógeno es N.

3- Añade el número de átomos como un subíndice. Para identificar la cantidad de átomos presentes en cada elemento, simplemente debes observar el prefijo del elemento. Memorizar los prefijos griegos te ayudará a escribir fórmulas químicas rápidamente sin tener que buscar nada.
Por ejemplo: dinitrógeno tiene el prefijo "di", que quiere decir 2. Por lo tanto, hay dos átomos de nitrógeno presentes.
Escribe "dinitrógeno" como N2.

4- Escribe el símbolo químico del segundo elemento. El segundo elemento es el "primer nombre" del compuesto y seguirá al primer elemento. Para los compuestos covalentes, el nombre del elemento tendrá el sufijo "uro" (o "ido" en caso de que el elemento sea oxígeno) en lugar de la terminación habitual del elemento.[4]
Por ejemplo: hexafluoruro de dinitrógeno. El segundo elemento es el fluoruro. Dado que "fluoruro" ya termina en "uro", simplemente déjalo como está. El símbolo químico del fluoruro es F.

5- Añade la cantidad de átomos presentes como un subíndice. Como lo hiciste con el primer elemento, identifica la cantidad de átomos presentes en el segundo elemento leyendo el prefijo. Usando este prefijo, escribe la cantidad de átomos como un subíndice a la derecha del símbolo químico.
Por ejemplo: hexafluoruro tiene el prefijo "hexa", que quiere decir 6. Por lo tanto, hay 6 átomos de fluoruro presentes.
Escribe "hexafluoruro" como F6.
La fórmula química final para el hexafluoruro de dinitrógeno es N2F6.

6- Practica con algunos ejemplos. Cuando apenas empiezas a aprender química, hay mucha memorización involucrada. Es un poco como aprender un nuevo idioma. Mientras más ejemplos utilices para practicar, te será más fácil descifrar las fórmulas químicas en el futuro y aprender el idioma de la química.
Dióxido de azufre: SO2
Tetrabromuro de carbono: CBr4
Pentóxido de difósforo: P2O5

Escribir formulas químicas de compuestos iónicos:
1- Identifica los símbolos químicos de los cationes y aniones. Todos los químicos tienen lo que puede llamarse un nombre y apellido. El nombre es el anión (ion negativo) mientras que el apellido es el catión (ion positivo). Los cationes se escriben como el nombre del elemento mientras que los aniones son el nombre del elemento con el sufijo "uro" (o "ido" en el caso de iones que contengan oxígeno).
Puedes encontrar el símbolo químico para cada elemento en la tabla periódica.
A diferencia de los compuestos covalentes, los prefijos griegos no se usan para indicar el número de átomos en cada elemento. Tienes que balancear las cargas de los elementos para determinar los átomos.
Por ejemplo, el óxido de litio es Li2O.

2- Reconoce los iones poliatómicos. A veces, el catión o anión es un ion poliatómico. Estos son moléculas que tienen dos o más átomos con grupos iónicos. No hay un buen truco para recordarlos, solo tienes que memorizarlos.
Solo existen 3 cationes poliatómicos y son el amonio (NH4+), el hidronio (H3+) y el mercurio (I) (Hg22+). Todos tienen una carga de +1.
El resto de los iones poliatómicos tiene cargas negativas que van desde el -1 hasta el -4. Algunos iones comunes son el carbonato (CO32-), el sulfato (SO42-), el nitrato (NO3-) y el cromato (CrO42-).

3- Determina la carga de valencia de cada elemento. La carga de valencia puede determinarse observando la posición del elemento en la tabla periódica. Hay unas cuantas reglas que debes tener en mente para ayudarte a identificar las cargas:[8]
Todos los elementos del grupo 1 tienen una carga de +1.
Todos los elementos del grupo 2 tienen una carga de +2.
Los elementos de transición tendrán números romanos para indicar la carga.
La carga de la plata es +1, la del zinc es +2 y la del aluminio es +3.
Los elementos del grupo 17 tienen una carga de -1.
Los elementos del grupo 16 tienen una carga de -2.
Los elementos del grupo 15 tienen una carga de -3.
Recuerda: al trabajar con iones poliatómicos, solo usa la carga del ion.

4- Balancea las cargas positivas y negativas de los iones. Una vez que hayas identificado la carga de cada elemento (o ion poliatómico), usarás estas cargas para determinar la cantidad de átomos presentes en cada elemento. La carga del compuesto debe ser igual a cero, así que añadirás átomos para balancear las cargas.[9]
Por ejemplo: el óxido de litio. El litio es un elemento del grupo 1 y tiene una carga de +1. El oxígeno es un elemento del grupo 16 y tiene una carga de -2. A fin de balancear la carga de -2 del oxígeno, necesitas dos átomos de litio. Por lo tanto, la fórmula química del óxido de litio es Li2O.

5- Practica con algunos ejemplos. La mejor forma de aprender a escribir las fórmulas es practicando con muchos ejemplos. Usa ejemplos de tu libro de química o busca ejercicios de práctica en línea. Haz tantos como puedas hasta que te sientas cómodo escribiendo fórmulas químicas.
Nitruro de calcio: el símbolo del calcio es Ca y el símbolo del nitrógeno es N. El calcio es un elemento del grupo 2 y tiene una carga de +2. El nitrógeno es un elemento del grupo 15 y tiene una carga de -3. Para balancearlo, necesitas 3 átomos de calcio (+6) y 2 átomos de nitrógeno (-6): Ca3N2.
Fosfato de mercurio (II): el símbolo del mercurio es Hg y el fosfato es el ion poliatómico PO4. El mercurio tiene una carga de +2 como lo indica el número romano II junto a él. El fosfato tiene una carga de -3. A fin de balancearlos, necesitarás 3 átomos de mercurio (+6) y 2 moléculas de fosfato (-6): Hg3(PO4)2.

BALANCE DE LAS REACCIONES QUÍMICAS
Aunque durante una reacción química ocurren interaccione entre moléculas, entre átomos o entre moléculas y átomos, es mas conveniente considerar que los procesos ocurren entre moles de moléculas y moles de átomos. Para que la representación de una reacción química pueda tomar el nombre de ecuación química, es necesario que este ajustada, es decir, que el primer miembro sea igual al segundo miembro, ya que no puede existir perdida de materia, de acuerdo con el principio de la conservación de la masa.
para balancear o ajustar reacciones químicas existen tres métodos: el método de tanteo, el método de los números de oxidación y el método del ion electrón.
método de tanteo o ensayo y error: muchas reacciones sencillas se pueden ajustar, por simple inspección, observando que el numero de átomos de determinado elemento que entra en la reacción, es el mismo que debe aparecer en el segundo miembro; y se colocan los coeficientes adecuados.
ejemplo: cuando el gas metano CH4 arde en el aire, se produce gas carbónico y agua; la reacción química es:
Esta reacción no se puede considerar como una ecuación debido a que en el primer miembro o (antes de la flecha) existen solamente dos átomos. igualmente, existen dos átomos de oxigeno en el primer miembro y tres átomos en el segundo miembro. El tanteo indica que para igualar los átomos de hidrógeno, se requiere anteponer el coeficiente 2 a la formula del agua en el segundo miembro (multiplique el coeficiente por el subíndice). Quedan ahora cuatro átomos de oxigeno en el segundo miembro y dos átomos en el primer miembro. Para igualarlos basta anteponer el coeficiente dos a la formula de la molécula de oxigeno. la ecuación está ajustada.
El metodo anterior se emplea en aquellas reacciones en que solo se producen desplazamientos o sustituciones, o cuando los procesos de oxidacion o reduccion son simples.
Método de números de oxidación: Se trata aquí de encontrar cual es el cambio total en el numero de oxidación para el oxidante y para el reductor e igualarlos. para ello se siguen las siguientes reglas:
- se escribe la ecuación correspondiente al proceso.
- se observa cual es el oxidante y cual el reductor y también cuales son los átomos que sufren variaciones en su numero de oxidación
- se calcula el numero de oxidación de estos átomos por cada molécula del compuesto, tanto en su forma oxidad como en la reducida
- se introducen en la ecuación los coeficientes mínimos que sean necesarios del oxidante y del reductor para que las variaciones del numero de oxidación sean iguales
- los coeficientes de las sustancias restantes aparecen en la reacción se ajustan automáticamente.
- si el oxidante o el reductor no actuar en su totalidad como tales, sino que también actúan en reacciones de doble descomposición (ácidos que actúan como oxidantes o como reductores y también como ácidos suministrando los aniones correspondientes), y el coeficiente definitivo de la sustancia sera el valor calculado, según las reglas anteriores, mas el numero de moléculas que intervienen en los procesos de doble descomposición.
Método del ion electrón: Puesto que el numero de electrones cedido por el reductor al oxidante debe ser igual al numero de electrones ganados por el oxidante al reducirse, las dos ecuaciones electrónicas se verifican en la misma extensión.
las siguientes reglas sirven para conseguir el equilibrio de este tipo de reacciones:
las siguientes reglas sirven para conseguir el equilibrio de este tipo de reacciones:
- la formula del oxidante se escribe iónica o molecular según la forma en la que actúa y al frente, separada por una flecha, se escribe la formula del reductor, también iónica o molecular según el caso.
- se introducen los coeficientes mínimos necesarios para igualar los átomos del elemento en la oxidación o en la reducción.
- si la forma reducida contiene menos oxigeno que la forma oxidante de la cual proviene, este oxigeno aparece en el segundo miembro en forma de H2O para o cual habrá que agregar los H+ necesarios al primer miembro.
- con esto se tiene la ecuación igualada atomicamente, pero debe también igualarse electricamente para lo cual se agregan los electrones necesarios para que la carga eléctrica en cada miembro sea la misma
- Las mismas operaciones deben efectuarse para la igualación del proceso de oxidación del reductor. si la forma oxidada contiene oxigeno en exceso, con respecto a la forma reducida, este oxigeno se obtiene de moléculas de H2O que se agregan al primer miembro con lo cual aparecerán los H+ correspondientes en el segundo miembro.
- se multiplican las dos ecuaciones (semirreacciones) por los coeficientes mínimos necesarios para igualar el numero de electrones que intervienen en ellas. las dos ecuaciones resultantes se suman y se cancelan los electrones, las moléculas de H2O y los H+ que aparezcan en ambos miembros.
si en la ecuación final quedan H+ en el segundo miembro pueden agregarse OH- en la misma cantidad a ambos miembros para obtener H2O en el segundo miembro.
CONCLUSIÓN
Finalmente sabemos que las reacciones químicas representan un evento de la realidad, porque, siguen una ley universal “la materia no se crea ni se destruye solo se transforma”.
También sabemos que una ecuación es la representación simbólica de las reacciones y que si los átomos no son de la misma cantidad tanto de reactivos como de productos la ecuación esta desequilibrada.
Todas estas reacciones suceden en alguna actividad de nosotros por ejemplo: al descomponerse la acidula de sodio mediante energía se separa el sodio y en nitrógeno: es lo que sucede cuando choca un carro.
Estas reacciones pasan sin que nos demos cuenta de cómo sus átomos se re acomodan, pero si lo podemos saber simbólicamente mediante un balanceo de ecuación química.
WEBGRAFÍA
- libro química y física resumidas
- libro química I
- libro quimica y ambiente
- https://es.wikihow.com/escribir-una-ecuaci%C3%B3n-qu%C3%ADmica