INTRODUCCION
Sean bienvenidos nuevamente en este blog, un espacio en el que les compartiremos información y temas de interés relacionados con los productos que ponemos a su disposición. En la entrada de hoy vamos a hablarles de qué es neutralizacion, que son y cómo funciona un indicador de pH y titulacion quimica.
Se llama neutralización a la reacción que se produce entre disoluciones acidas y básicas. Todas estas reacciones dan como producto una sal y agua. En el siguiente blog encontraras informacion acerca de la neutralizacion y conceptos basicos para con ello lograr dominar con facilidad este tema entendiendo que la neutralizacion es una reacción química que ocurre cuando los reaccionantes están constituidos por un ácido y una base. Generalmente son reacciones exotérmicas y el calor asociado se conoce como Calor de neutralización. A continuacion entenderas todo de manera mas didactica con algunos ejercicios relaionados con este tema.
En el mercado existen distintas herramientas para medir el potencial de hidrogeno de alimentos, medicamentos y sustancias químicas; cada herramienta cumple con la finalidad necesaria, pero sus aplicaciones y los medios en donde se utilizan son distintos. En las industrias alimenticias o en otros ramos se suele utilizar un indicador de pH, que es una sustancia química que cambia de color cuando la disolución modifica su pH dentro de cierto rango.
Se llama neutralización a la reacción que se produce entre disoluciones acidas y básicas. Todas estas reacciones dan como producto una sal y agua. En el siguiente blog encontraras informacion acerca de la neutralizacion y conceptos basicos para con ello lograr dominar con facilidad este tema entendiendo que la neutralizacion es una reacción química que ocurre cuando los reaccionantes están constituidos por un ácido y una base. Generalmente son reacciones exotérmicas y el calor asociado se conoce como Calor de neutralización. A continuacion entenderas todo de manera mas didactica con algunos ejercicios relaionados con este tema.
En el mercado existen distintas herramientas para medir el potencial de hidrogeno de alimentos, medicamentos y sustancias químicas; cada herramienta cumple con la finalidad necesaria, pero sus aplicaciones y los medios en donde se utilizan son distintos. En las industrias alimenticias o en otros ramos se suele utilizar un indicador de pH, que es una sustancia química que cambia de color cuando la disolución modifica su pH dentro de cierto rango.
OBJETIVOS
- Preparar soluciones diluidas a partir de soluciones concentradas
- Expresar la concentración de la solución final en unidades químicas y físicas
- Determinar la concentración de una solución desconocida por titilación
- Aprender a utilizar un equipo de titulación, en una volumetría ácido-base.
- Conocer la fundamentación de una reacción ácido-base.
- Determinar el punto de equivalencia de una reacción ácido-base.
- Determinar el punto final de una reacción utilizando indicadores.
- Determinar la naturaleza de una solución, si es ácida o básica.
-Reconocer que cuando se titula un ácido fuerte con una base fuerte la concentración de H3O+ es igual a la concentración del ácido fuerte.
- Identificar por medio de la curva de titulación ácido-base el volumen y el pH en el punto de equilibrio.
- Determinar el punto de equivalencia de una reacción
ácido-base, mediante el uso de un indicador
- Justificar mediante los resultados obtenidos la validez de la reacción química que se establece entre un ácido fuerte y una base fuerte
- Definir sustancias ácidas y básicas según el modelo de Brönsted-Lowry (intercambio de protones) y explicar las insuficiencias de teorías anteriores como la de Arrhenius.
- De una lista de sustancias, identificar las que pueden actuar como ácidos, como bases o como ambos, justificándolo con la correspondiente reacción con agua, y escribiendo la pareja conjugada de cada uno de ellos
- Escribir el equilibrio de ionización del agua, conocer el significado y valor de su producto iónico y utilizarlo en cálculos de concentraciones en equilibrio de iones hidronio e hidróxido.
- Describir el diferente comportamiento de disoluciones de ácidos fuertes y débiles (y de bases fuertes y débiles).
- Escribir la expresión de la constante de acidez (y de basicidad) de una sustancia y relacionarla con su carácter fuerte o débil de acidez (o basicidad).
NEUTRALIZACION
La reacción entre un ácido y una base se llama neutralización. Cuando en la reacción participan un ácido fuerte y una base fuerte se obtiene una sal y agua. Si una de las especies es de naturaleza débil y la neutralización se produce en disolución acuosa también se obtiene su respectiva especie conjugada y agua. Se puede decir que la neutralización es la combinación de iones hidronio y de aniones hidróxido para formar moléculas de agua. Durante este proceso se forma una sal.
Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor.
Podemos resumir el proceso así:
ácido + base → sal + agua
Concretamos con algunos ejemplos los productos obtenidos al reaccionar un ácido y una base:
Durante este proceso se forma una sal. Acción y efecto de neutralizar o neutralizarse: anulación o moderación del efecto de una acción con su contraria. La neutralización es la disminución o anulación del efecto de cierta acción porque aparece otra contraria que la contrarresta: por ejemplo, si se bebe alcohol se puede producir una neutralización del efecto de un antibiótico que se ha tomado. En química, la reacción química de un ácido con una base; el producto formado es: la sal correspondiente de estos compuestos y agua. La neutralización es un proceso químico mediante el cual una sustancia o un compuesto químico pierde sus propiedades ácidas o básicas; reacción química que se produce entre un ácido y una base para formar una sal y agua. En lingüística, el fenómeno definido originalmente en la fonología cuando una oposición entre dos fonemas deja de ser distintiva. En fonética, la pérdida de una oposición fonológica distintiva en un contexto fónico determinado. En política, la situación del Estado que renuncia permanentemente a la guerra. Régimen de neutralidad permanente con que se coloca una ciudad o territorio. En deporte, la anulación de un periodo de tiempo o una parte de una competición deportiva, de manera que no tenga valor para el resultado final.
Características:
En primer lugar, se debe enfatizar que si una reacción de neutralización se inicia con cantidades iguales del ácido y de la base (en moles), cuando finaliza dicha reacción se obtiene solamente una sal; es decir, no hay cantidades residuales de ácido o base.
Además, una propiedad muy importante de las reacciones ácido-base es el pH, el cual indica qué tan ácida o básica es una solución. Este se determina por la cantidad de iones H+ que se encuentran en las soluciones medidas.
Por otro lado, existen varios conceptos de acidez y basicidad dependiendo de los parámetros que se tomen en consideración. Un concepto que destaca es el de Brønsted y Lowry, que considera un ácido como una especie capaz de donar protones (H+) y una base como la especie capaz de aceptarlos.
Titulaciones ácido-base:
Para estudiar apropiadamente y de manera cuantitativa una reacción de neutralización entre un ácido y una base se aplica una técnica llamada titulación (o valoración) ácido-base.
Las titulaciones ácido-base consisten en determinar la concentración de ácido o base necesaria para neutralizar una cantidad determinada de base o ácido de concentración conocida.
En la práctica, se debe añadir gradualmente una solución patrón (cuya concentración se conoce con exactitud) a la solución cuya concentración se desconoce hasta que se alcance el punto de equivalencia, donde una de las especies ha neutralizado de manera completa a la otra.
El punto de equivalencia se detecta mediante el cambio violento de color del indicador que se ha añadido a la solución de concentración desconocida cuando se ha completado la reacción química entre ambas soluciones.
Por ejemplo, en el caso de la neutralización del ácido fosfórico (H3PO4) habrá un punto de equivalencia por cada protón que se desprenda del ácido; es decir, se tendrán tres puntos de equivalencia y se observarán tres cambios de coloración.
Productos de una reacción de neutralización
En las reacciones de un ácido fuerte con una base fuerte se lleva a cabo la neutralización completa de las especies, como en la reacción entre el ácido clorhídrico y el hidróxido de bario:
2HCl(ac) + Ba(OH)2(ac) → BaCl2(ac) + 2H2O(l)
Así que no se generan iones H+ u OH– en exceso, lo cual significa que el pH de las soluciones de electrolitos fuertes que se han neutralizado está intrínsecamente relacionado con el carácter ácido de sus reactantes.
Por el contrario, en el caso de la neutralización entre un electrolito débil y uno fuerte (ácido fuerte + base débil o ácido débil + base fuerte) se obtiene la disociación parcial del electrolito débil y aparece la constante de disociación del ácido (Ka) o de la base (Kb) débil, para determinar el carácter ácido o básico de la reacción neta mediante el cálculo del pH.
Por ejemplo, se tiene la reacción entre el ácido cianhídrico y el hidróxido de sodio:
HCN(ac) + NaOH(ac) → NaCN(ac) + H2O(l)
En esta reacción el electrolito débil no se ioniza notablemente en la solución, por lo que se representa la ecuación iónica neta de la siguiente manera:
HCN(ac) + OH–(ac) → CN–(ac) + H2O(l)
Esta se obtiene luego de escribir la reacción con los electrolitos fuertes en su forma disociada (Na+(ac) + OH–(ac) en el lado de los reactantes, y Na+(ac) + CN–(ac) en el lado de los productos), donde solo el ion sodio es un espectador.
Finalmente, en el caso de la reacción entre un ácido débil y una base débil no se produce dicha neutralización. Esto se debe a que ambos electrolitos se disocian de manera parcial, sin dar como resultado el agua y la sal esperados.
Ejemplos de neutralizacion:
Tenemos una solución ácida con 10 gramos de ácido sulfúrico. Calcular la cantidad necesaria de hidróxido de potasio para neutralizarla e indicar los productos resultantes.
La fórmula de la reacción es:
H2SO4 + 2KOH --> K2SO4 + 2H2O
Acido Hidróxido Sulfato Agua
Sulfúrico de potasio de potasio
Por lo que un mol de ácido sulfúrico se neutraliza con dos moles de hidróxido de potasio.
Calculamos la masa molecular del ácido sulfúrico:
Masa atómica de sus componentes:
H = 1 Total = 2
S = 32 Total = 32
O = 16 Total = 64
Masa molecular del ácido sulfúrico: 98 g/mol.
Ahora calculamos la masa molecular del hidróxido de potasio:
K = 39 Total = 39
H = 1 Total = 1
O = 16 Total = 16
Masa molecular del hidróxido de potasio: 56 g/mol
Ahora, conforme a nuestra fórmula, tenemos que para neutralizar un mol de ácido sulfúrico, necesitamos dos moles de hidróxido de potasio, por lo que multiplicamos por 2 el peso del hidróxido de potasio, lo que nos da 112 gramos/mol. Para calcular la cantidad de hidróxido de potasio que necesitamos para neutralizar los 10 gramos de ácido sulfúrico, aplicamos la regla de 3:
10:98 = x:112
112 X 10 = 1120 / 98 = 11.428 gramos de hidróxido de potasio son necesarios para neutralizar 10 gramos de ácido sulfúrico.
También lo podíamos calcular dividiendo, para establecer la relación de sustancias:
98/10 = 9.8 que es la relación de sustancias reaccionantes
112/9.8 = 11.428
Y en cuanto a las sustancias resultantes, tendremos:
Masa molecular del sulfato de potasio:
K = 39 Total = 78
S = 32 Total = 32
O = 16. Total = 64
Por lo que la masa molecular del sulfato de potasio, es de 174 g/mol.
Y del agua
H = 1 Total = 2
O = 16 Total = 16
Masa molecular del agua: 18 g/mol.
Tenemos entonces que se produce una molécula de sulfato de potasio y dos de agua.
Las dividimos por la relación de sustancias reaccionantes, y entonces tenemos:
135 / 9.8 = 13.775 g de sulfato de potasio
36 / 9.8 = 3.673 gramos de agua.
Y se desprende calor.
PROCEDIMIENTO
1.
2.
3.
4.
5.
6.
PH E INDICADORES
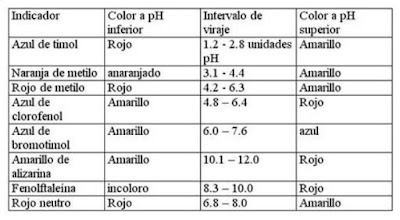
Un indicador de pH es una sustancia que permite medir el pH de un medio. Habitualmente, se utilizan como indicador de las sustancias químicas que cambian su color al cambiar el pH de la disolución. El cambio de color se debe a un cambio estructural inducido por la protonación o desprotonación de la especie. Los indicadores Ácido-base tienen un intervalo de viraje de una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Los más conocidos son el naranja de metilo, que vira en el intervalo de pH 3,1 - 4,4, de color rojo a naranja, y la fenolftaleína, que vira desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en disoluciones con colores rosados / violetas.
Los indicadores son colorantes orgánicos, que experimentan una variación de color que se puede observar en una escala numérica llamada escala pH. Según estén en presencia de una sustancia ácida o básica el color es de un tono determinado.
Este indicador está dividido en ácidos y bases y en la parte central donde se encuentran estas dos substancias, se encuentra otro tipo de carácter llamado neutro, en el que la substancia está equilibrada. Es decir, tiene tanto carácter básico como ácido.
Caracteristicas:
El pH es una característica de todas las sustancias determinadas por la concentración de iones de hidrógeno (H +). Cuanto menor es el pH de una sustancia, mayor es la concentración de iones H + y menor la concentración de iones OH-.
Según Arrhenius, un medio que presenta hidronios es ácido, y el que presenta hidróxidos es básico. Sin embargo, debemos relacionar la cantidad de ambos iones (H + y OH-), lo que hace que la clasificación de un medio siga estos principios:
- Medio ácido: concentración de hidronios> (mayor) que la de hidróxidos.
- Medio neutro: concentración de hidronios = (igual) a de hidróxidos.
- Medio básico: concentración de hidronios < (menor) que la de hidróxidos.
Los valores de pH varían de 0 a 14, los valores por debajo de 0 y por encima de 14 son posibles, pero muy raros y no se pueden medir con los aparatos convencionales.
Así, podemos clasificar un medio por medio del valor del pH de la siguiente manera:
Para pH = 7, el medio será neutro (indica que [H +] = [OH-]);
Para pH> 7, el medio será básico (indica que [H +] < [OH-]);
Para pH <7, el medio será ácido (indica que [H +]> [OH-]).
Las sustancias que poseen valores de pH 0 a 7, se consideran ácidas, valores en torno a 7 son neutras y valores por encima de 7 se denominan básicas o alcalinas. El pH de una sustancia puede variar según su composición, concentración de sales, metales, ácidos, bases y sustancias orgánicas y de la temperatura.
La escala del pH puede variar de 0 a 14, y cuanto menor sea el índice del pH de una sustancia, más ácida será esta sustancia.
Ejemplo:
Pongamos como ejemplo el comportamiento del indicador azul de bromotimol, en tres soluciones diferentes: la solución ácida, neutra y básica.
- Al añadir nuestro indicador azul de bromotimol, en un tubo de ensayo que contenga una disolución de HCl por ejemplo, veremos un color amarillo en la solución, que tendrá un pH < 6.0.
- Si añadimos el mismo indicador a otro tubo de ensayo, esta vez relleno de agua, veremos que tendrá una coloración verde, con un pH= 7.
- Por último, cuando añadimos el indicador de azul de bromotimol, a un tubo de ensayo que contenga una disolución de NaOH, veremos como ésta se tiñe de azul, con un pH > 7.6. Se comprueba de este modo que el intervalo de viraje está entre 6.0 y 7.6.
El papel indicador universal, es gran utilidad en los laboratorios para poder medir de manera muy sencilla los diferentes pH de las disoluciones. Su manejo es extremadamente sencillo, pues basta con introducir un trocito de papel en la disolución problema, y éste inmediatamente mostrará un color determinado, que puede ir desde el rojo al azul, dependiendo si es ácida o básica.
PROCEDIMIENTO
1.
2.
3.
TITULACIÓN
La titulación, o también conocida como valoración, tiene como objetivo determinar la concentración de una disolución ácida o básica, llamada disolución analizada o muestra problema. Esto se logra adicionando pequeños volúmenes de una disolución de concentración conocida, llamada disolución valorada.
La titulación o valoración ácido-base es un método de análisis químico que permite determinar la concentración de una disolución ácida o básica desconocida, mediante una neutralización controlada.
Para realizar el procedimiento experimental, se debe colocar en un matraz Erlenmeyer un volumen determinado de la disolución desconocida, es decir, disolución problema. Desde una bureta se deja caer gota a gota la disolución patrón, es decir, la disolución de concentración conocida, hasta llegar al punto de equivalencia, que es el punto donde no queda ácido ni base libre en la muestra.
Para determinar en qué momento se llega al punto de equivalencia, antes de iniciar la titulación se deben agregar unas gotas de indicador, que generalmente es fenolftaleína. En el momento en que se aprecia un cambio de color del indicador, se ha llegado al punto final.
Preparación de una muestra para titulación:
En una titulación o valoración, tanto la sustancia patrón como el analito deben estar en fase líquida (o en disolución). Si la muestra no es un líquido o una disolución, debe ser disuelta. Si el analito está muy concentrado en la muestra a analizar, suele diluirse. Aunque la amplia mayoría de las titulaciones se llevan a cabo en disolución acuosa, pueden usarse otros disolventes como ácido acético o etanol con igual finalidad, para determinados análisis. Una cantidad medida de muestra se coloca en un frasco donde se disuelve y se diluye si es necesario. El resultado matemático de la valoración puede calcularse directamente mediante la cantidad de valorante medida. Cuando la muestra ha sido disuelta o diluida previamente a la valoración, la cantidad de disolvente utilizado para disolver o diluir debe ser bien conocida (generalmente es un coeficiente entero) para poder considerarlo en el resultado matemático de la valoración de la muestra original. Muchas valoraciones requieren un cierto control del pH de la reacción. Para ello, se usan disoluciones amortiguadoras añadidas en el frasco de la disolución a analizar para mantener el pH de la solución. En otros casos se debe enmascarar un cierto ion: esto es necesario cuando hay dos reactivos en la muestra que pueden reaccionar con la sustancia patrón y solo queremos valorar uno de ellos, o bien cuando la reacción puede ser inhibida o alterada por la presencia de ese ion. Se procede añadiendo otra disolución a la muestra para enmascarar o secuestrar el ion no deseado, mediante la formación de un enlace débil con él o incluso formando una sustancia insoluble. Algunas reacciones redox pueden requerir calentar la disolución con la muestra y valorar mientras está todavía caliente (para incrementar la velocidad de reacción). Por ejemplo, la oxidación de ciertas soluciones de oxalato requiere calentar la solución hasta unos 60 grados centígrados para mantener una adecuada velocidad de reacción.
¿De que depende el éxito de una titulación?
Considerando que un operador de laboratorio trabaja en condiciones óptimas, de modo de disminuir los errores sistemáticos al máximo, el éxito de la titulación dependerá de la buena elección del valorante e indicador para el analito en cuestión.
Esta selección deberá estar fundamentada en varios factores:
- se debe conocer la reacción de titulación que ocurre.
- esta reacción debería tener una constante de equilibrio muy grande (idealmente infinita).
- el valorante debe tener alta selectividad, es decir reaccionar solamente con el analito.
Cómo hacer una titulación:
La titulación es una técnica empleada en química para determinar la concentración de un reactivo conocido mezclado con uno desconocido. Si la usas correctamente y con cuidado obtendrás resultados muy precisos.
Pasos:
- Consigue los materiales enumerados más adelante en la sección “Cosas que necesitarás”.
- Enjuaga la bureta y elimina las impurezas.
- Limpia y enjuaga todos los materiales de vidrio con agua de grifo (el agua desionizada funciona mejor), si es necesario usa un poco de detergente. Ten mucho cuidado con las buretas, ya que son muy frágiles. Siempre sostenlas con ambas manos.
- Enjuaga todos los materiales de vidrio con agua destilada para reducir la posibilidad de contaminación.
- Mide una cantidad precisa de analito (el reactivo conocido mezclado con el desconocido).
- Llena el vaso de precipitados o matraz de Erlenmeyer con una pequeña cantidad de agua destilada.
- Enjuaga el analito en el vaso de precipitados o matraz de Erlenmeyer, asegurándote de que todo el analito está dentro del vaso de precipitados.
- Coloca una pequeña cantidad (4 a 5 gotas) del indicador de color adecuado en el vaso de precipitados.
- Agita el contenido del vaso de precipitados haciéndolo girar en círculos.
- Llena la bureta con una cantidad de exceso de titrante (sustancia química que reacciona con el analito). El titrante debe estar en forma acuosa.
- Con mucho cuidado sujeta la bureta a un soporte de bureta. La punta de la bureta no debe tocar ninguna superficie.
- Coloca el vaso de precipitados debajo de la bureta.
- Registra el volumen inicial de la bureta en el menisco (la parte más baja de la inmersión en el líquido).
- Gira la llave de paso de la bureta (válvula cerca de la punta) vertical, para verter el titrante en el vaso de precipitados. Vierte solo una pequeña cantidad del titrante. Debe producirse un cambio de color. Agita el vaso de precipitados hasta que el color desaparezca.
- Repite el paso anterior hasta que el color quede en un tono casi imperceptible (apenas podrás notarlo, así que ten cuidado y hazlo muy despacio).
- Registra el volumen de la bureta.
- Cuando te estés acercando al punto final, añade el titrante gota por gota.
- Agita el contenido del vaso de precipitados después de cada gota.
- Detente cuando hayas alcanzado el punto final, en el cual el reactivo dentro del analito ha sido completamente neutralizado. Habrás alcanzado el punto final cuando cambie de color, dependiendo del indicador que has elegido utilizar.
- Registra el volumen final.
- Añade gotas de titrante hasta que pases el punto final. En este punto, luego de añadir el titrante, el contenido del vaso de precipitados debe ser completamente del color del indicador de color.
- Elimina toda el agua estancada.
- Deshazte de los productos químicos usados y colócalos en un contenedor de desperdicios etiquetado.
- Calcula la concentración del reactivo dentro del analito usando los datos obtenidos.
Consejos:
- Mantén tus ojos al mismo nivel mientras lees el volumen de la bureta, si tus ojos están en un nivel diferente cada vez que lees el volumen, las lecturas no serán tan precisas.
- Si no eres cuidadoso y observador, es muy probable que sobrepases el punto final. Cuando tengas la más mínima sensación de que estás acercándote al punto final, empieza a contar las gotas y ve muy despacio.
- Se deben realizar cálculos de la concentración para el número apropiado de cifras significativas.
- Recuerda sacar el embudo filtrante después de haber llenado la bureta con el titrante, ya que puede evitar que tu titulación sea exacta.
- Manipula la bureta con cuidado, ya que se puede romper con facilidad.
- Registra el volumen de la bureta restando un dígito a la lectura obtenida (por ejemplo: si la bureta tiene lecturas hasta la décima más próxima; registra tu observación en la centésima más próxima).
- Es más fácil determinar si se ha alcanzado el punto final si colocas una tarjeta blanca debajo del matraz de manera que puedas ver si el indicador ha cambiado de color.
- Coloca un vaso de precipitados pequeño en la parte superior de la bureta, en especial si estás haciendo una titulación con NaOH, ya que si se deja en contacto con el aire algunos de los OH se unirán con las moléculas de agua y perturbarán la molaridad de la solución de NaOH.
- Mantén un cristal de reloj sobre los matraces que contienen el agua y el reactivo desconocido, ya que si se encuentran expuestos mientras estás haciendo otras titulaciones, su molaridad puede cambiar.
PROCEDIMIENTO:
CONCLUSIÓN
Los acidos y las bases estan presentes en nuestra vida diaria y desempeñamos papeles muy importantes. Algunas características de ambos son fácilmente reconocibles por ejemplo cuando te bañas y te caes en los ojos. Estas son constantes en la base de una base y tu carácter irritante.
Podemos deducir que los ácidos y las bases, tienen sus orígenes tras largos procesos de experimentación, en donde no solo existió solo una teoría sino que tres , cada una de ella con igual importancia.
Los ácidos & las bases poseen características que los hacen esenciales, y son de importancia fundamental ya que se encuentran insertos en nuestra vida cotidiana.
Además concluimos la relación que posee el pH y el papel tornasol dentro de los ácidos y bases.